
PD-L1免疫组化检测的现状及存在的问题
北京中杉金桥生物技术有限公司研发部 戚闻摘译
众所周知,肿瘤的发生率逐年提高已经成为一个不争的事实,随之而来的是人类抗肿瘤治疗方法的不断更新。肿瘤的治疗在经历了手术、放疗、化疗和靶向治疗后,已经逐渐进入了免疫治疗的阶段。免疫治疗是通过激发和增强机体抗肿瘤的免疫应答来协同机体免疫系统杀伤肿瘤、抑制肿瘤生长,是一种利用患者自身免疫系统对抗肿瘤的治疗方式。肿瘤的免疫治疗分为被动免疫治疗和主动免疫治疗两类。I-O(Immuno-Oncology) 治疗是主动免疫治疗的主要手段之一,目前国际上I-O治疗的主要研究方向是免疫检查点抑制剂,有代表性的包括PD-1/PD-L1抑制剂和CTLA-4拮抗剂。
免疫检查点是一类免疫抑制性的分子,可以调节免疫反应的强弱和范围,从而避免正常组织的损伤和破坏,在肿瘤的发生、发展过程中,免疫检查点成为免疫耐受的主要原因之一。免疫检查点疗法就是通过共抑制或共刺激信号等一系列途径调节T细胞活性来提高抗肿瘤免疫反应的治疗方法。
PD-1是T细胞表面的重要抑制分子,其胞内段含有一个ITIM和一个免疫受体酪氨酸转换基序(ITSM),ITSM介导了蛋白酪氨酸磷酸酶家族磷酸酶的募集以及对T细胞活化信号的抑制,其配体为PD-L1和PD-L2,主要在免疫系统效应期的肿瘤微环境中发挥重要作用。PD-L1在多种肿瘤细胞和肿瘤微环境的造血细胞中有诱导性的表达,通过与PD-1的结合,诱导产生机体的免疫抑制,从而使肿瘤细胞获得免疫逃逸,这也许是肿瘤耐受的机制之一。如果将其结合阻断,就有可能阻断这种免疫抑制,使机体自身的T细胞活化,从而达到免疫治疗的目的。由于多种肿瘤均有可能通过上述机制进行免疫抑制,所以免疫检查点抑制剂就有可能成为抗肿瘤的“万能药”。理论上讲,如果能够证实肿瘤中存在PD-1/PD-L1的高表达,那么免疫检查点抑制剂就有可能有效,所以目前世界各大药厂均把目光聚集在这类药物的研发上,并且已经先后有三种药物经过美国FDA批准上市,预计明年也会通过CFDA认证在中国上市。国内的多家药企同类药物也有多项正在进行Ⅲ期临床测试,市场前景广阔。
目前FDA已批准上市的免疫检查点抑制剂有百时美施贵宝的nivolumab和默沙东的pembrolizumab,两者均为PD-1抑制剂。nivolumab是全人源化IgG4单抗,其主要适应症是恶性黑色素瘤及BRAF V600野生型不可切除性或转移性黑色素瘤、非小细胞肺癌、转移性肾细胞癌、霍奇金淋巴瘤和头颈部鳞癌等;pembrolizumab是人源化IgG4单抗,主要适应症是晚期或不可切除的恶性黑色素瘤、非小细胞肺癌等二线治疗,更于今年10月获NCCN推荐用于非小细胞肺癌一线治疗并获FDA批准。
FDA批准的PD-L1抑制剂是罗氏制药的ateolizumab,是迄今批准的唯一一个PD-L1抑制剂,为全人源化的IgG1单抗,与PD-L1高亲和力结合后阻断了PD-L1与PD-1的相互作用,达到抑制PD-1/PD-L1通路的作用,临床试验的适应症主要为非小细胞肺癌和移行性膀胱癌。
到目前为止,三种药物的使用适应症大多需要进行PD-L1免疫组化检测,绝大多数肿瘤均在高表达的肿瘤中获得良好的效果,所以FDA在批准三种药物上市的同时,也分别批准了相应的伴随诊断试剂。
FDA批准的OPDIVO?(nivolumab)伴随诊断免疫组化试剂为PD-L1 IHC 28-8 pharmDx,应用兔单抗28-8和EnVision FLEX可视系统,在Autostainer Link 48染色平台上检测非小细胞肺癌(鳞癌除外)和黑色素瘤石蜡切片中PD-L1的表达状况,从而指导临床用药。PD-L1蛋白表达的定义是肿瘤细胞所呈现的任何强度的细胞膜阳性的百分率,细胞质染色(如果存在)不参与评分。在非小细胞肺癌(鳞癌除外)中,应用该伴随诊断试剂所检测出的PD-L1表达与使用OPDIVO所获得的延长生存期相关,如果PD-L1表达阴性,即<1%的非小细胞肺癌(鳞癌除外)肿瘤细胞呈现出任何强度的完整的或不完整的线性化细胞膜染色,此条件下服用OPDIVO的效果与服用多烯紫杉醇(对照)的效果等同;若>=1% PD-L1表达,服用OPDIVO有41%的可能性(病人)延长8.1月生存期;若>=5% PD-L1表达,服用OPDIVO有57%的可能性(病人)延长10.1月生存期;若>=10% PD-L1表达,服用OPDIVO有60%的可能性(病人)延长11.4月生存期。在黑色素瘤中,该伴随诊断试剂所检测的PD-L1表达与使用药物的无进展生存期相关。非小细胞肺中鳞癌用药与PD-L1表达无关。
FDA批准的KEYTRUDA?(pembrolizumab)伴随诊断免疫组化试剂为PD-L1 IHC 22C3 pharmDx,应用小鼠单抗22C3和EnVision FLEX可视系统,在Autostainer Link 48染色平台上检测非小细胞肺癌石蜡切片中PD-L1的表达状况,从而指导临床用药。PD-L1蛋白应用TPS(Tumor Proportion Score)来定义,即呈现部分或完整细胞膜染色的可视肿瘤细胞的百分率。如果TPS≥ 50%,即为PD-L1阳性,也就意味着适合用药;反之,如果TPS在1~49%,即为PD-L1阴性,不适合用药。
FDA批准的TECENTRIQ?(ateolizumab)伴随诊断免疫组化检测试剂为VENTANA PD-L1 (SP142) Assay,应用兔单抗SP142和OptiView DAB IHC检测试剂盒,在VENTANA BenchMark ULTRA染色平台对尿路上皮癌的石蜡切片进行PD-L1表达的分析。PD-L1表达状况定义为任何强度PD-L1+的浸润免疫细胞(IC)所占据的肿瘤细胞面积的百分比,肿瘤细胞上的PD-L1表达不参与评分。在尿路上皮癌中≥ 5% IC与使用药物所带来的客观缓解率增加密切相关。近期,该伴随诊断试剂又扩大至于非小细胞肺癌,其评判标准也进行了改进,除了继续沿用针对IC表达进行评判之外,也加入了对于TC的评判,是唯一一个对肿瘤细胞和浸润的淋巴细胞均加以考虑的检测试剂,评估基于PD-L1任何强度表达的肿瘤浸润性免疫细胞占肿瘤面积的比例(%IC)或PD-L1任何强度表达在肿瘤细胞中的比例(% TC)。 VENTANA PD-L1 (SP142)检测测定的NSCLC组织中≥50% TC或≥10% IC有PD-L1表达可能与TECENTRIQ(atezolizumab)提高总生存率相关。
不难看出,目前针对PD-L1的检测状况是“One drug,One assay”,这种“一种药物一种检测”的模式,包括不同的诊断标准,已严重地影响到伴随诊断在病理日常诊断工作中的应用。FDA在陆续批准上述伴随诊断试剂的同时,也意识到了这种问题的存在,所以由FDA牵头,四家PD-1/PD-L1 抑制剂研发企业(AstraZeneca、BMS、Roche、Merck)、二家诊断试剂公司(Dako/Agilent 、Ventana/Roche)和二家学术机构(IASLC:the International Association for the Study of Lung Cancer及AACR:American Association for Cancer Research)参与,进行了名为蓝印倡议(Blueprint Initiative)的研究,通过对四种方法(包括目前尚未被批准的SP263兔单抗)进行对比,找到其可能的一致性,用于指导临床合理使用PD-1/PD-L1抑制剂。但不对抗体的好和坏进行评判;不评估检测的特异性和敏感性;不判定临床和治疗的关系。
从阶段Ⅰ的数据来看,四种检测方法中,28-8、22C3和SP263在肿瘤染色方面一致性较好,唯有SP142是个例外;在四种方法中,免疫细胞上PD-L1的表达较之肿瘤细胞上的表达差异性更大(参见图1和2);依然有36.9%的病例表现出不一致的结果。免疫组化依然作为检测PD-L1蛋白表达的金标准,鼓励使用阳性/阴性来定义PD-L1的表达,但可能会朝向定义更加多元化的判定来替代单一的Cutoff值。
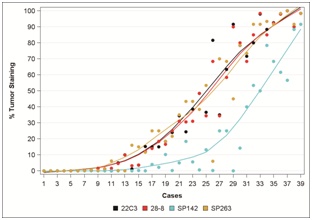

阶段Ⅰ的结果对现阶段的临床影响有限,原因是入组的试验样本数量过少,样本类型单一。随着人们对不同免疫检查点药物反应性不同背后所隐藏的生物学意义的更加深入的了解,更新的检测方法和使用复杂的生物标记物来捕捉肿瘤微环境的变化,以及这些变化与药物的相关性;探索新的标记物与治疗的相关性,包括突变负荷、新抗原、基因图谱、PD-L1基因组扩增、CTCs中PD-L1的表达、细胞游离的DNA、感染性肿瘤、复合免疫分析、肿瘤内异质性、基线血清细胞因子、LDH、基因表达特性等等,都会变得更加有意义。